¿Cuán peligroso es el monóxido de carbono?

Figura 1. Monóxido de Carbono.
Figura 2. Representación gráfica del monóxido de carbono
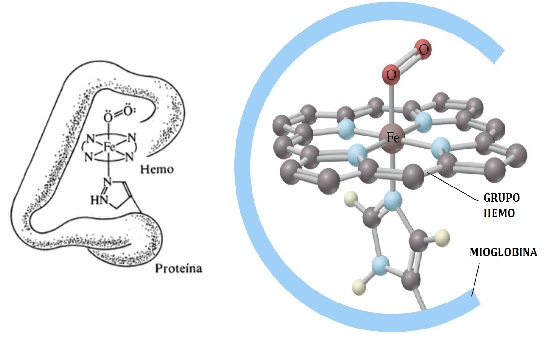
Figura 3. Representaciones gráfica de la hemoglobina.
La hemoglobina durante su ciclo forma oxihemoglobina en los pulmones por la combinación con el oxígeno. El oxígeno es luego liberado en los tejidos en los que es necesario para el progreso del metabolismo celular y es posteriormente reemplazado por una molécula de dióxido de carbono (CO2) formando carbaminohemoglobina volviendo hacia los pulmones e iniciando el ciclo nuevamente.
Desde el punto de vista químico la hemoglobina es un complejo formado por un átomo central (Hierro) que se encuentra enlazados otras entidades moleculares que lo rodean llamadas ligandos. ¿Pero a qué viene todo esto? Bueno tantos los centros metálicos como los ligandos poseen propiedades electrostáticas únicas las cuales definen la afinidad entre ellos, esto puede ser observado en la serie espectroquímica donde los lingandos se ordenan según dicha propiedad. El hecho es que el oxígeno molecular puede ser fácilmente removido de la hemoglobina por la molécula de monóxido de carbono debido a que esta es más afín a la hemoglobina formando así un complejo llamado carboxihemoglobina que es del orden de 200 veces más fuerte que el complejo formado con el oxígeno, esto inutiliza por completo la molécula de hemoglobina debido a que es un proceso irreversible. disminuyendo así la capacidad de trasporte de oxígeno en la sangre, por lo cual resulta ser letal para el ser humano en la mayoría de los casos.
Ahora bien, ¿Por qué las personas no advierten que están siendo envenenadas? El problema está en que los síntomas que se presentan por este tipo de intoxicación incluyen dolor de cabeza, náuseas, malestar y fatiga. Síntomas que por lo general son confundido con los de otras enfermedades como la influenza y la intoxicación por comida. Además, una vez que el cuerpo está siendo afectado por el monóxido de carbono resulta difícil tomar decisiones o razonar porque se genera distracción y confusión debido a la falta de oxígeno en el cerebro. Por lo que generalmente la respuesta a estos síntomas es descansar o incluso dormir lo cual resulta de gravedad. La intensidad y la velocidad con que aparecen estos síntomas dependen del grado de exposición al monóxido de carbono. Esto puede ser apreciado en la tabla 1.

Para tener mas o menos una referencia un automóvil con el catalizador del sistema escape completamente averiado emite gases con una concentración de monóxido de carbono de 7.000 ppm, este valor puede incrementar dependiendo de que tan buena es la combustión interna del motor, por esto es importante darle el respectivo mantenimiento al vehículo.
La alta toxicidad del CO ha sido usada desde los tiempos de Aristóteles, quien reporto que de los carbones o brasas encendidas emanaba vapores tóxicos, en esos tiempos aún no se conocía el monóxido de carbono como tal, pero este era usado para ejecutar a criminales al encerrarlo en habitaciones con gran cantidad de carbones encendidos. Este gas fue también usado a gran escala en el Holocausto por los nazis para ejecutar gran cantidad de prisioneros, historia que ya todos conocemos.
En la actualidad la intoxicación por monóxido de carbono es la causa principal de envenenamiento mortal en el mundo. Sin embargo, hasta la fecha no existe antídoto que sea lo suficientemente eficaz para combatir este problema. El tratamiento que se emplea para esta afección es simplemente suministrar oxígeno puro a la persona afectada. Sin embargo, existen estudios en progreso prometedores, donde han sintetizado diversos tipos de proteínas que son más afines al monóxido de carbono por lo cual este podría ser extraído de la hemoglobina de forma eficaz, además estas proteínas tienen la capacidad de ser desechadas fácilmente a través de diversos procesos biológico. Lo cual significaría una alternativa eficaz incluso para casos de intoxicación grave, debido a que el efecto es inmediato.

Figura 4. Prevención ante el monóxido de carbono.
Para finalizar, es bueno conocer un poco respecto al tema de manera que podamos evaluar posibles fuentes de este gas peligroso y tomar todas las precauciones posibles, además poder detectar los síntomas característicos y combatir la afección a tiempo podría ser la diferencia entre la vida y la muerte.
Referencias.
- Carbon monoxide.
- Carbon monoxide poisoning.
- Hemoglobina.
- Intoxicación por monóxido de carbono: Por fin un antídoto.
- Goldstein M, (2008). "Carbon monoxide poisoning". Journal of Emergency Nursing, 34 (6), 538–542.
- Bleecker M, (2015). "Carbon monoxide intoxication" Hand Book of Clinical Neurology, 131, 191-203.
Excelente aporte @anibalmdz, muchas veces lo que uno sabe sobre los sustancias toxicas es que son muy peligrosas para nosotros, sin mas, sin detallar cuales son los efectos exactos que nos causan. Saludos pana..!
Gracias José espero q sea de utilidad, saludos.